Quotidiano on line
di informazione sanitaria
Sabato 23 NOVEMBRE 2024
Governo e Parlamentodi informazione sanitaria
Sabato 23 NOVEMBRE 2024
La mission e i numeri dell’Ema
La sua missione consiste nel coordinare le conoscenze e le risorse scientifiche degli Stati membri, che valutano tali informazioni scientifiche nell'ambito di "comitati" e forniscono pareri scientifici. L'Ente regolatorio conta 890 membri. La maggior parte di questi, nonostante l'Agenzia avesse sede a Londra, provengono dalla Francia e dall'Italia. Ema, ad oggi, ha raccomandato l'autorizzazione all'immissione in commercio di 81 medicinali, incluse 27 nuove sostanze attive.
20 NOV - Oggi è stata deciso che Ema sarà trasferita ad Amsterdam. L'Ema ha assunto le proprie funzioni nel 1995. La sua missione consiste nel valutare e sorvegliare i medicinali per uso umano e veterinario per motivi di sicurezza, efficacia e qualità al fine di proteggere la salute umana e animale nell'UE. L'Agenzia di per sé non svolge attività di ricerca (non effettua attività di laboratorio, test su animali o sperimentazioni cliniche) né produce medicinali.L'Ema riceve fascicoli di domanda e informazioni da varie fonti, ad esempio l'industria, gli Stati membri, il personale sanitario e i pazienti. La sua missione consiste nel coordinare le conoscenze e le risorse scientifiche degli Stati membri, che valutano tali informazioni scientifiche nell'ambito di "comitati" e forniscono pareri scientifici. L'agenzia si affida alle competenze interne del suo personale e alle conoscenze scientifiche esterne fornite dagli Stati membri.
Le attività principali dell'Ema sono le seguenti:
- fornire un unico iter di valutazione dei medicinali innovativi nell'UE, evitando in tal modo la duplicazione delle valutazioni negli Stati membri (procedura centralizzata);
- monitorare la sicurezza di tutti i medicinali autorizzati nell'UE durante il loro intero ciclo di vita;
- stimolare ricerca e innovazione fornendo consulenza e orientamenti scientifici agli sviluppatori di medicinali;
- coordinare le ispezioni tese ad accertare l'osservanza delle buone pratiche cliniche, di fabbricazione e di laboratorio;
- ospitare i servizi informatici per attuare la politica e la legislazione dell'UE in campo farmaceutico.
L'Ente regolatorio, stando ai dati del 2015, conta 890 membri. La maggior parte di questi, nonostante l'Ema avesse sede a Londra, provengono dalla Francia e dall'Italia che rappresentano, rispettivamente, il 12,58% ed il 12,36% dei suoi lavoratori. Al terzo posto troviamo la Spagna sopra il 10%. Un dato, questo, che potrebbe avere un suo peso nella scelta della nuova sede.
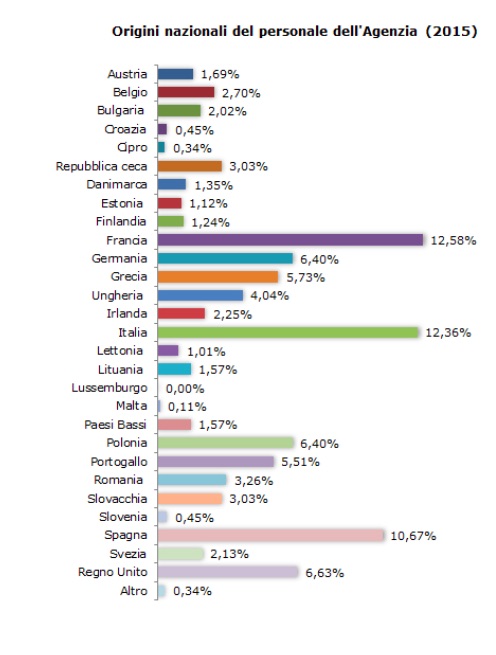
Continuando ad analizzare i numeri dell'Agenzia possiamo notare come Ema abbia raccomandato l'autorizzazione all'immissione in commercio di 81 medicinali, incluse 27 nuove sostanze attive (ossia sostanze che non sono mai state autorizzate precedentemente in un medicinale all'interno dell'UE) nonché di 11 nuovi medicinali veterinari, sei dei quali contengono una nuova sostanza attiva. Ha ricevuto 84 domande nell'ambito di PRIME (medicinali prioritari), un nuovo programma che fornisce un supporto tempestivo e intensificato ai medicinali che potrebbero potenzialmente rispondere alle esigenze non ancora soddisfatte dei pazienti.
In totale sono state ricevute 114 domande di valutazione iniziale. Ha inoltre ricevuto 118 notifiche di prodotti ritirati da parte di case farmaceutiche, e 672 richieste di ispezione per la verifica delle buone prassi di fabbricazione e 121 per la verifica delle buone prassi cliniche. Le richieste di informazione ricevute sono state in totale 1843.
G.R.
20 novembre 2017
© Riproduzione riservata
Altri articoli in Governo e Parlamento
gli speciali
Quotidianosanità.it
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale e operativa:
Via della Stelletta, 23
00186 - Roma
Quotidiano online
d'informazione sanitaria.
QS Edizioni srl
P.I. 12298601001
Sede legale e operativa:
Via della Stelletta, 23
00186 - Roma
Direttore responsabile
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Luciano Fassari
Direttore editoriale
Francesco Maria Avitto
Tel. (+39) 06.89.27.28.41
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
info@qsedizioni.it
redazione@qsedizioni.it
Coordinamento Pubblicità
commerciale@qsedizioni.it
Copyright 2013 © QS Edizioni srl. Tutti i diritti sono riservati
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy
- P.I. 12298601001
- iscrizione al ROC n. 23387
- iscrizione Tribunale di Roma n. 115/3013 del 22/05/2013
Riproduzione riservata.
Policy privacy






