QS Edizioni - lunedì 25 novembre 2024
Regioni e Asl
Rintracciabilità del sangue, importazione e attività trasfusionali: la Stato-Regioni dà il via libera a regole e riparti
- allegati(3)
 20 aprile - Doppio parere e un accordo per il riparto tra le Regioni dei fondi sulla rintracciabilitòà di sangue ed emocompontenti per le trasfusioni sulla protezione degli emoderivati e sulle regole per l'importazione degòli emoderivat. I TESTI: ATTIVITA' TRASFUSIONALI - RINTRACCIABIITA' DEL SANGUE - IMPORTAZIONE EMOCOMPONENTI.
20 aprile - Doppio parere e un accordo per il riparto tra le Regioni dei fondi sulla rintracciabilitòà di sangue ed emocompontenti per le trasfusioni sulla protezione degli emoderivati e sulle regole per l'importazione degòli emoderivat. I TESTI: ATTIVITA' TRASFUSIONALI - RINTRACCIABIITA' DEL SANGUE - IMPORTAZIONE EMOCOMPONENTI.
Via libera in Stato-Regioni agli obiettivi e ai criteri per il riparto tra le Regioni dei fondi per la rintracciabilità del sangue e degli emocomponenti destinati a trasfusioni (parere), alle disposizioni sull’importazione ed esportazione del sangue umano e dei suoi prodotti (parere) e al riparto per la nuova disciplina delle attività trasfusionali e della protezione degli emoderivati (accordo).
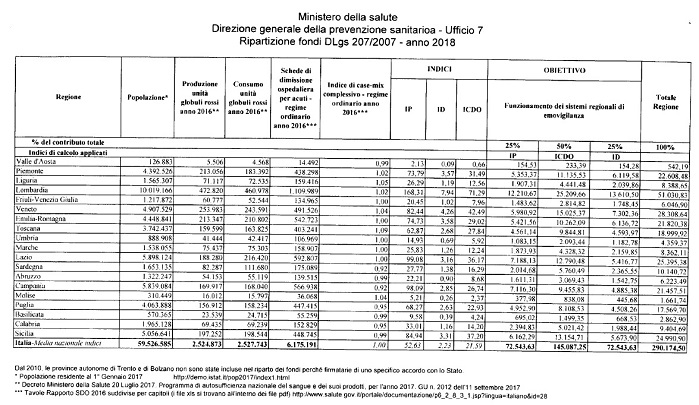
L’accordo sul riparto dei fondi riguarda circa 847 milioni che secondo la legge 219/2005 servono per il rispetto degli impegni regionali per l'autosufficienza regionale e nazionale di emocomponenti e plasmaderivati e riguardano in particolare la loro attività di attuazione programmi di produzione, consumo e compensazione.
Il riparto è stato calcolato in base a:
- IP (indice di popolazione residente): posta pari a 1.000 la popolazione residente in Italia, l'indice rappresenta la quota di residenti della regione diviso 1.000;
- ICDO (indice di consumo di globuli rossi / dimissioni ospedaliere): indice di consumo di globuli rossi diviso ii numero di dimissioni ospedaliere per acuti (Sdo) moltiplicato l'indice di case-mix complessivo - regime ordinario, moltiplicato per l'indice di popolazione residente;
- ID (Indice di donazione): numero di unità di globuli rossi raccolte nella regione diviso il numero di residenti moltiplicato per l'indice di popolazione residente.
Per quanto riguarda l’importazione, tra le altre misure è previsto che quella dei prodotti del sangue destinati alla produzione di medicinali a uso umano sia autorizzata dall'Aifa, o comunque a questa notificata. Le aziende importatrici devono essere regolarmente e preventivamente autorizzate alla produzione di medicinali emoderivati.
L'Aifa può chiedere ai soggetti richiedenti la presentazione di ulteriore documentazione a comprova dei requisiti di origine, qualità e sicurezza e se ritenuto necessario, può chiedere informazioni o chiarimenti anche alle Autorità competenti dei Paesi esportatori e all'Ema.
L'Aifa può stabilire accordi bilaterali con le Autorità competenti di Paesi terzi per favorire lo scambio di informazioni e semplificare la documentazione da presentare per ii rilascio dell'autorizzazione all'importazione.
Nell'ambito delle valutazioni della documentazione presentata per l'importazione, può disporre per motivate ragioni che il richiedente sottoponga al controllo di Stato, lotto per lotto, i prodotti del sangue da importare ovvero i pool di plasma da cui essi derivano. Tali controlli devono essere eseguiti presso l'Iss o altro Omcl (official medicines control laboratories ).
L'Aifa può effettuare le ispezioni dei centri in cui si effettuano le fasi di raccolta, controllo, lavorazione (inclusa la separazione degli emocomponenti), congelamento, conservazione, stoccaggio e trasporto e delle officine di produzione ubicati in Paesi terzi, in accordo con la normativa vigente. Le certificazioni rilasciate a questi centri e officine, da parte di altre competenti Autorità europee nei tre anni precedenti, sono tenute in considerazione per evitare l’eventuale ripetizione di attività ispettive.
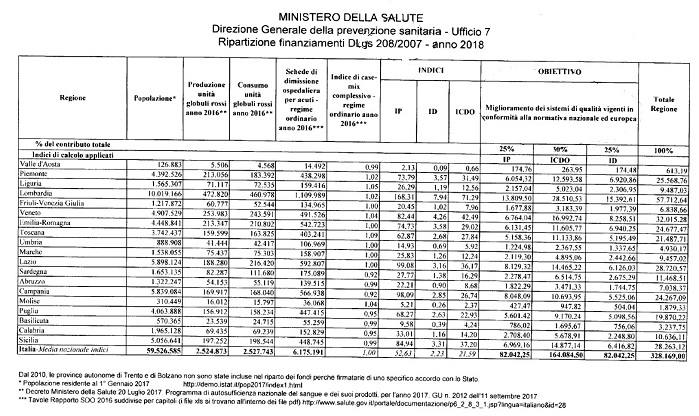
Ripartiti infine anche i finanziamenti 2018. da destinare al sistema trasfusionale per le finalità previste dal Dlgs 207/2007 (rintracciabilità e notifica eventi avversi) e dal Dlgs 208/2007 (sistema qualità dei servizi trasfusionali).
Si tratta rispettivamente di risorse attualmente disponibili sui rispettivi capitoli del bilancio de! ministero della Salute pari a 580.349 euro e a 656.338 euro.
Riguardo la ripartizione la legge di stabilità 2016 ha stabilito che avvenga destinando ii 50% alle regioni e ii 50% al Centro nazionale sangue per le attività, di coordinamento de/la rete trasfusionale".
Quindi, ferma restando la diretta assegnazione al CNS, per le attività di coordinamento della rete trasfusionale del 50% delle risorse stanziate sui rispettivi capitoli di bilancio (290.174,50 euro per il Dlgs 207/2007 e 328.169,00 euro per il Dlgs 208/2007) il CNS ha fatto pervenire la proposta di ripartizione tra le Regioni del rimanente 50% delle risorse su cui è stato espresso parere positivo dalle Regioni.

L’accordo sul riparto dei fondi riguarda circa 847 milioni che secondo la legge 219/2005 servono per il rispetto degli impegni regionali per l'autosufficienza regionale e nazionale di emocomponenti e plasmaderivati e riguardano in particolare la loro attività di attuazione programmi di produzione, consumo e compensazione.
Il riparto è stato calcolato in base a:
- IP (indice di popolazione residente): posta pari a 1.000 la popolazione residente in Italia, l'indice rappresenta la quota di residenti della regione diviso 1.000;
- ICDO (indice di consumo di globuli rossi / dimissioni ospedaliere): indice di consumo di globuli rossi diviso ii numero di dimissioni ospedaliere per acuti (Sdo) moltiplicato l'indice di case-mix complessivo - regime ordinario, moltiplicato per l'indice di popolazione residente;
- ID (Indice di donazione): numero di unità di globuli rossi raccolte nella regione diviso il numero di residenti moltiplicato per l'indice di popolazione residente.
Per quanto riguarda l’importazione, tra le altre misure è previsto che quella dei prodotti del sangue destinati alla produzione di medicinali a uso umano sia autorizzata dall'Aifa, o comunque a questa notificata. Le aziende importatrici devono essere regolarmente e preventivamente autorizzate alla produzione di medicinali emoderivati.
L'Aifa può chiedere ai soggetti richiedenti la presentazione di ulteriore documentazione a comprova dei requisiti di origine, qualità e sicurezza e se ritenuto necessario, può chiedere informazioni o chiarimenti anche alle Autorità competenti dei Paesi esportatori e all'Ema.
L'Aifa può stabilire accordi bilaterali con le Autorità competenti di Paesi terzi per favorire lo scambio di informazioni e semplificare la documentazione da presentare per ii rilascio dell'autorizzazione all'importazione.
Nell'ambito delle valutazioni della documentazione presentata per l'importazione, può disporre per motivate ragioni che il richiedente sottoponga al controllo di Stato, lotto per lotto, i prodotti del sangue da importare ovvero i pool di plasma da cui essi derivano. Tali controlli devono essere eseguiti presso l'Iss o altro Omcl (official medicines control laboratories ).
L'Aifa può effettuare le ispezioni dei centri in cui si effettuano le fasi di raccolta, controllo, lavorazione (inclusa la separazione degli emocomponenti), congelamento, conservazione, stoccaggio e trasporto e delle officine di produzione ubicati in Paesi terzi, in accordo con la normativa vigente. Le certificazioni rilasciate a questi centri e officine, da parte di altre competenti Autorità europee nei tre anni precedenti, sono tenute in considerazione per evitare l’eventuale ripetizione di attività ispettive.
Ripartiti infine anche i finanziamenti 2018. da destinare al sistema trasfusionale per le finalità previste dal Dlgs 207/2007 (rintracciabilità e notifica eventi avversi) e dal Dlgs 208/2007 (sistema qualità dei servizi trasfusionali).
Si tratta rispettivamente di risorse attualmente disponibili sui rispettivi capitoli del bilancio de! ministero della Salute pari a 580.349 euro e a 656.338 euro.
Riguardo la ripartizione la legge di stabilità 2016 ha stabilito che avvenga destinando ii 50% alle regioni e ii 50% al Centro nazionale sangue per le attività, di coordinamento de/la rete trasfusionale".
Quindi, ferma restando la diretta assegnazione al CNS, per le attività di coordinamento della rete trasfusionale del 50% delle risorse stanziate sui rispettivi capitoli di bilancio (290.174,50 euro per il Dlgs 207/2007 e 328.169,00 euro per il Dlgs 208/2007) il CNS ha fatto pervenire la proposta di ripartizione tra le Regioni del rimanente 50% delle risorse su cui è stato espresso parere positivo dalle Regioni.



20 aprile 2018
© QS Edizioni - Riproduzione riservata
- Allegati
- Nuova disciplina attività trasfusionali e protezione emoderivati
- Importazione sangue umano
- Rintracciabilità del sangue e qualità servizi trasfusionali